الخميس، 12 يناير 2012
الخصائص الكيميائية العامة
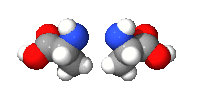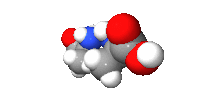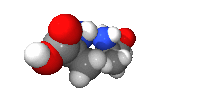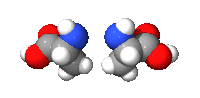
تكون الرابط البيبتيدي
الرابط البيبتيدي : وهي الاصرة التي تتشكل بين جزيئتين عندما تتفاعل مجموعة الكربوكسيل للجزيئة الأولى مع مجموعة الامينو للجزيئة الثانية محررة جزيئة الماء (H2O) ويدعى هذا التفاعل بالتآلف الجاف وكذلك يسمى (تفاعل التكثيف) ويحدث بين الاحماض الامينية. أن الآصرة الناتجة من هذا التفاعل وهي CO-NH تسمى الاصرة البيبتيدية وتدعى الجزيئة الناتجة بالأميد، وألاميدات مركبات عضوية تحتوي مجموعة وظيفية تدعى الاميد وهي عبارة عن زمرة كربونيل متصلة بزمرة أمين.
2- نزع الكربوكسيل تجرد الحامض الاميني من مجموعة الكاربوكسيل Decarboxylation عند تجريد المجموعة الكاربوكسيلية من الحوامض الأمينية فأنها تتحول إلى الأمينات الأولية وذلك بمساعدة الأنزيمات من نوع Decarboxylation
3- نزع الأمين تجريد المجموعة الأمينية (بالإنجليزية: Deamination) عند تجريد الحوامض الأمينية من مجموعة الأمين تتحول إلى حوامض كاربوكسيلية وأمونيا والحوامض الكاربوكسيلية تتمثل في الجسم إلى مركبات تستفاد منها الخلية أما الامونيا فأنها تطرح في البول على شكل يوريا بواسطة دورة تسمى بدورة اليوريا والتي تحدث في الكبد وذلك بتخليص الجسم من النتروجين أو من الامونيا السادة
4 - نقل الأمين تفاعل نقل مجموعة الأمين (بالإنجليزية: Transmination) ويتم في هذا التفاعل انتزاع مجموعة الامين بواسطة الاكسدة ونقلها من مركب إلى أخر من المركبات المتفاعلة، يتم هذا التفاعل بمساعدة انزيمات (Transminase) حيث تتحول الحوامض الأمينية إلى حوامض كيتونية والتي بدروها تتحول إلى مشتقات كاربوهيداتية تستفاد منها الخلية
5- نترزة التفاعل مع حامض النتروز يستعمل هذا التفاعل لغرض قياس كمية الحامض الاميني في محلول معين حيث يتفاعل حامض النتروز مع الحامض الاميني محرراً النتروجين الذي يكمل جمعه وحساب حجمه يمكن تصنيف كمية الحامض الاميني
6- التفاعل: (بالإنجليزية: Nihydrin) Nihydrin: مادة مؤكسدة قوية تتفاعل مع الحوامض الأمينية لتعطي مركب أزرق اللون يعتمد هذا التفاعل على وجود مجموعتي الأمين والكاربوكسيل بشكر حر وهذا التفاعل يكون حساس لكشف عن المركبات قليلة من الحوامض الامينية
7- تفاعل سانكر (بالإنجليزية: Sanger) يستعمل هذا التفاعل لتشخيص الحامض الأميني الموجود في بداية السلسلة الببتيدية (النهاية النتروجينية) يستعل كاشف (D.VFB) 2,4- Dinitre fluro Benzen حيث يتفاعل هذا المركب مع الحامض الأميني الأول في نهاية النتروجينية من السلسلة الببتيدية مكونا مركب أصفر اللون حيث يشخص الحامض الأميني المرتبط به بواسطة Chromatogralply في هذا التفاعل تتحرر الاحماض الامينية من السلسلة الببتيدية بشكل حر ويعتبر هذا التفاعل مدمراً للسلسلة الببتيدية وذلك بتحرير الحوامض الأمينية بشكل حر.
8- تفاعل إيدمان (بالإنجليزية: Edman reaction) يستعمل هذا التفاعل لمعرفة تتابع (Sequence) في السلسلة الببتيدية ويعتبر هذا التفاعل مهم لأنه يحطم السلسلة الببتيدية ويمكن تكراره مع السلسلة الناتجة لحد عشرين حامض أميني أو أكثر يستعمل في هذا التفاعل الكاشف Phenyl iso thioCyngtac.
الرابط البيبتيدي : وهي الاصرة التي تتشكل بين جزيئتين عندما تتفاعل مجموعة الكربوكسيل للجزيئة الأولى مع مجموعة الامينو للجزيئة الثانية محررة جزيئة الماء (H2O) ويدعى هذا التفاعل بالتآلف الجاف وكذلك يسمى (تفاعل التكثيف) ويحدث بين الاحماض الامينية. أن الآصرة الناتجة من هذا التفاعل وهي CO-NH تسمى الاصرة البيبتيدية وتدعى الجزيئة الناتجة بالأميد، وألاميدات مركبات عضوية تحتوي مجموعة وظيفية تدعى الاميد وهي عبارة عن زمرة كربونيل متصلة بزمرة أمين.
[عدل] الخاصيات الأيونية والقطبية الكهربائية
[عدل] التفاعلات الكيميائية
1- الخواص الامينية للحوامض الامينية: بالنظر لاحتواء الحوامض الامينية على مجموعتين الأمين والكاربوكسيل لذا فأنها تعتبر ثنائية القطب أي تعمل كحامض أو كقاعدة وتسمى امفوتيرية أي تفقد وتكتسب بروتون لهذا فانها إذا وضعت في محاليل حامضية قوية PH = 1 تتقبل بروتون وتشحن (+) واذا وضعت في محاليل قاعدية قوية تفقد بروتون وتنشحن (-) اما في نقطة التعادل الكهربائي (Pl-) هي النقطة التي تتساوى فيها عدد (+) مع (-) وتكون PH معينة لكل حامض أميني كالاتي: أ- الحوامض الأمينية المتعادلة:- محصلة الشحنة = صفر P1=PH= (5-6.3) ب- القاعدية: محصلة الشحنة == صفر P1 = PH == (7.6-10.8) ج- الحامضية محلصة الشحنة == صفر P1 = PH == (2.97-3.2)2- نزع الكربوكسيل تجرد الحامض الاميني من مجموعة الكاربوكسيل Decarboxylation عند تجريد المجموعة الكاربوكسيلية من الحوامض الأمينية فأنها تتحول إلى الأمينات الأولية وذلك بمساعدة الأنزيمات من نوع Decarboxylation
3- نزع الأمين تجريد المجموعة الأمينية (بالإنجليزية: Deamination) عند تجريد الحوامض الأمينية من مجموعة الأمين تتحول إلى حوامض كاربوكسيلية وأمونيا والحوامض الكاربوكسيلية تتمثل في الجسم إلى مركبات تستفاد منها الخلية أما الامونيا فأنها تطرح في البول على شكل يوريا بواسطة دورة تسمى بدورة اليوريا والتي تحدث في الكبد وذلك بتخليص الجسم من النتروجين أو من الامونيا السادة
4 - نقل الأمين تفاعل نقل مجموعة الأمين (بالإنجليزية: Transmination) ويتم في هذا التفاعل انتزاع مجموعة الامين بواسطة الاكسدة ونقلها من مركب إلى أخر من المركبات المتفاعلة، يتم هذا التفاعل بمساعدة انزيمات (Transminase) حيث تتحول الحوامض الأمينية إلى حوامض كيتونية والتي بدروها تتحول إلى مشتقات كاربوهيداتية تستفاد منها الخلية
5- نترزة التفاعل مع حامض النتروز يستعمل هذا التفاعل لغرض قياس كمية الحامض الاميني في محلول معين حيث يتفاعل حامض النتروز مع الحامض الاميني محرراً النتروجين الذي يكمل جمعه وحساب حجمه يمكن تصنيف كمية الحامض الاميني
6- التفاعل: (بالإنجليزية: Nihydrin) Nihydrin: مادة مؤكسدة قوية تتفاعل مع الحوامض الأمينية لتعطي مركب أزرق اللون يعتمد هذا التفاعل على وجود مجموعتي الأمين والكاربوكسيل بشكر حر وهذا التفاعل يكون حساس لكشف عن المركبات قليلة من الحوامض الامينية
7- تفاعل سانكر (بالإنجليزية: Sanger) يستعمل هذا التفاعل لتشخيص الحامض الأميني الموجود في بداية السلسلة الببتيدية (النهاية النتروجينية) يستعل كاشف (D.VFB) 2,4- Dinitre fluro Benzen حيث يتفاعل هذا المركب مع الحامض الأميني الأول في نهاية النتروجينية من السلسلة الببتيدية مكونا مركب أصفر اللون حيث يشخص الحامض الأميني المرتبط به بواسطة Chromatogralply في هذا التفاعل تتحرر الاحماض الامينية من السلسلة الببتيدية بشكل حر ويعتبر هذا التفاعل مدمراً للسلسلة الببتيدية وذلك بتحرير الحوامض الأمينية بشكل حر.
8- تفاعل إيدمان (بالإنجليزية: Edman reaction) يستعمل هذا التفاعل لمعرفة تتابع (Sequence) في السلسلة الببتيدية ويعتبر هذا التفاعل مهم لأنه يحطم السلسلة الببتيدية ويمكن تكراره مع السلسلة الناتجة لحد عشرين حامض أميني أو أكثر يستعمل في هذا التفاعل الكاشف Phenyl iso thioCyngtac.
تصنيف الأحماض الأمينية
تقسم الأحماض الألفا-أمينية العشرون الموجودة في البروتينات، والمشفرة في المعلومة الوراثية، إلى مجاميع حسب عدد من الخصائص الفيزيائية، الكيميائية والأحيائية :

(م) رمز السيستين C يمكن أن يكتب أيضا S-HC، إذا كان الجذر الكبريتي (-HS) حرا أو S-SC، إذا كان هذا الجذر مرتبطا بجذر كبريتي لسيستين أخرى في السلسلة البيبتيدية. وتختلف الخاصيات أيضا في هذه الحالة، فالسيستين المرتبطة تصير غير قطبية.
(م م) هذه الأحماض الأمينية تصير أساسية في مراحل النمو الأولى وعند الأطفال.
- الطبيعة الكيميائيـة للسلسلة الجانبيـة : بما أن المجموعة الجانبية R هي التي تحدد هوية الحمض الأميني، يمكن اذن تقسيم الأحماض الأمينية إلى ذات سلسلة هيدروكاربونية، اما أليفاتية Aliphatic أو أروماتية Aromatic أو مختلفة الحلقة Heterocyclic.
- القطبيـة الكهربائيـة : تقسم الأحماض الأمينية حسب قطبيتها الكهربائية، وذلك حسب حالة التأين، إلى قطبية Polar (سالبة أو موجبة الشحنة) أو غير قطبية Nonpolar (عديمة الشحنة). تحدد هذه الخاصية المهمة قابلية الأحماض الأمينية للانحلال في الماء (و الماء هو محلول قطبي)، فتكون الأحماض الأمينية ذات المجاميع الجانبية R القطبية متجاذبة مع الماء Hydrophilic، وهي عادة ما تكون على الجزء الخارجي للبروتينات. بينما الأحماض الأمينية ذات السلاسل الجانبية غير القطبية، وغير المتجاذبة مع الماء Hydrophobic، تميل إلى التجمع للداخل.

مخطط فيين لتصنيف الأحماض الأمينية إلى زمر (أنظر إلى الجدول أسفله)، حسب الخاصيات الكيميائية للمجاميع الجانبية وقطبيتها الكهربائية.
- القاعديـة \ الحمضيـة : السلسلة الجانبية R من الممكن أن تكون قاعدية، مثل حمض الليسين Lysine أو الأرجنين Arginine وهو شديد القاعدية، أو حمضية، مثل الجلوتميت Glutamic acid والأسبارتيت Aspartic acid، أو متعادلة مثل الجليسين والليوسين Leucine. وعادة ما تكون الأحماض الأمينية ذات المجاميع الجانبية القاعدية والحمضية قطبية جدا وهي توجد بصورة كبيرة على سطح البروتينات المماس للماء.
- يمكن أيضا أن نقسم الأحماض الأمينية حسب أهميتها الغذائية وتوفرها الأحيائي إلى :
- أحماض أمينية أساسية Essential لا يصنعها الجسم، ويجب تناولها في الغذاء. مثال، الليوسين والليسين.
- أحماض أمينية شبه-أساسية Semi-essential يستطيع الجسم تخليقها ولكن ليس بكميات كافية، خاصة في مرحلة النمو، ويحبذ أن تتوفر في الغذاء. مثال، الأرجنين والهستيدين Histidine.
- أحماض أمينية غير أساسية Nonessential متوفرة في الجسم السليم بكميات دائمة، ولا تستلزم حضورها في الغذاء. مثال، الجليسين والبرولين Proline.
[عدل] قــائمة تصنيف الأحمــاض الألفا-الأمينيـة المكونة للبروتينات[5]
أنظر إلى المقال المفصل التالي قائمة الأحماض الأمينية| الحمض الأميني | الرمـز (ثلاثة حروف) | الرمـز (حرف واحد) | الكتلة الذرية (غ \ مول) | قطبية السلسلة الجانبية | حمضية أو قاعدية السلسلة الجانبية | الأهمية الغذائية |
|---|---|---|---|---|---|---|
| ألانين Alanine | Ala | A | 89,1 | غير قطبي | متعـادل | غير أساسي |
| أرجنين Arginine | Arg | R | 174,20 | قطبي | قاعـدي (قوي) | شبه-أساسي |
| أسباراجين Asparagin | Asn | N | 132,12 | قطبي | متعـادل | غير أساسي |
| أسبارتيت Aspartic acid | Asp | D | 133,10 | قطبي | حمضـي | غير أساسي |
| سيستئين Cysteine | Cys | C (م) | 121,16 | قطبي | متعـادل | غير أساسي (م م) |
| جلوتامين Glutamin | Gln | Q | 146,15 | قطبي | متعـادل | غير أساسي |
| جلوتاميت Glutamic acid | Glu | E | 147,13 | قطبي | حمضـي | غير أساسي |
| جليسين Glycine | Gly | G | 75,07 | غير قطبي | متعـادل | غير أساسي |
| هيستدين Histidine | His | H | 155,16 | قطبي | قاعـدي (ضعيف) | شبه-أساسي |
| ايزوليوسين Isoleucine | Ile | I | 131,17 | غير قطبي | متعـادل | أساسـي |
| ليوسين Leucine | Leu | L | 131,17 | غير قطبي | متعـادل | أساسـي |
| ليسين Lysine | Lys | K | 146,19 | قطبي | قاعـدي | أساسـي |
| ميثيونين Methionine | Met | M | 149,21 | غير قطبي | متعـادل | أساسـي |
| فينيلألانين Phenylalanine | Phe | F | 165,19 | غير قطبي | متعـادل | أساسـي |
| برولين Proline | Pro | P | 115,13 | غير قطبي | متعـادل | غير أساسي |
| سيرين Serine | Ser | S | 105,09 | قطبي | متعـادل | غير أساسي |
| ثريونين Threonine | Thr | T | 119,12 | قطبي | متعـادل | أساسـي |
| تريبتوفان Tryptophan | Trp | W | 204,23 | قطبي | متعـادل | أساسـي |
| تيروسين Tyrosin | Tyr | Y | 181,19 | قطبي | متعـادل | غير أساسي (م م) |
| فالين Valine | Val | V | 117,15 | غير قطبي | متعـادل | أساسـي |
(م) رمز السيستين C يمكن أن يكتب أيضا S-HC، إذا كان الجذر الكبريتي (-HS) حرا أو S-SC، إذا كان هذا الجذر مرتبطا بجذر كبريتي لسيستين أخرى في السلسلة البيبتيدية. وتختلف الخاصيات أيضا في هذه الحالة، فالسيستين المرتبطة تصير غير قطبية.
(م م) هذه الأحماض الأمينية تصير أساسية في مراحل النمو الأولى وعند الأطفال.
البنية الكيميائية العامة الاحماض الامينية
يعتبر هيدروكسي كرباميد (بالإنجليزية: Hydroxycarbamide) الحمض الأميني الأبسط من حيث التركيب فهو متكون من جذر أميني متصل مباشرة بكربون جذر الهيدروكسيل. وهذا المركب غير أحيائي. أما في بقية الأحماض الأمينية فتدخل ذرة أو أكثر من الكربون بين هذين الجذرين. ويحدد موقع الأمين في السلسلة الكربونية الفئة التي ينتمي إليها الحمض الأميني كما يلي:
ولا تنطبـق هـذه القـاعدة الا على السيستيـن (بالإنجليزية: Cysteine) لأن الجذر الكبريتي ليسـت له الأولوية في هذه الحالــة. اذن فالـ D -سيستين هو الـ S -سيستين، والـ L -سيستين هو الـ R -سيستين [2].
و في المثال الموجود على النموذج المقابل، نجد الـ D -ألانين وكأنه صورة عبر المرآة لالـ L -ألانين، وهما مركبان لا يمكن مطابقتهما non-superimposable، تماما كما لا يمكن مطابقة قفى اليد اليمنى مع ظهر اليد اليسرى صورة. ولسبب لا يزال محيرا، فان غالبية الأحماض الألفا-أمينية المكونة للبروتينات هي من النضيرة L وليست D. ولكن يمكن أن نجد بعض الـ D-أحماض أمينية في أنواع مـن الصدفيات [3] مثل عائلة الكونيدات Conidae، وفي الغشاء البيبتدوسكري Peptidoglycan لبعض البكتيريا [4].
- حموض ألفا-أمينية، حيث يتصل جذر الأمين بالكربون رقم 2 بعد كربون جذر الهيدروكسيل ويرقم بألفا Cα. يسمى المركب بالحمض 2-أمينوايتانويك Aminoethanoic acid، أو ما يعرف بالغليسين Glycine، أبسط الحموض الأمينية لدى الكائنات الحية. أما بقية الأحماض الألفا-أمينية فلها نفس البنية مع اختلاف في السلسلة الجانبية R، فعوضا عن ذرة الهيدروجين المرتبطة بالكربون ألفا في الغليسين، تتخذ أنواع مختلفة، على سبيل المثال، جذر المثيل Methyl في حالة الألانين Alanine أو جذر مختلف الحلقة Heterocyclic بالنسبة للتريبتوفان Tryptophan. والدور الأساسي للأحماض الألفا-أمينية هو بناء مختلف البروتينات.
- حموض بيتا-أمينية، يرتبط جذر الأمين بالكربون الثالث بداية من كربون جذر الهيدروكسيل Cβ، وأبسط ممثل أحيائي لهذه الفئة هو البيتا-ألانين، يتأتي من تحلل الكارنوسين Carnosine، ويلعب دور ناقل عصبي مثبط للغليسين.
- حموض جاما-أمينية، يتحد جذر الأمين بالكربون الرابع بعد كربون جذر الهيدروكسيل Cγ، المثال المعروف في هذه الفئة هو حامض الجاما-بيتيريك GABA، وهو كذلك ناقل عصبي مثبط.
[عدل] التماثلية البصرية (التناظر)
لدى جميع الأحماض الألفا-أمينية، باستثناء الجليسين، يكون الكربون-ألفا مرتبطا بجذور مختلفة ومجموعة جانبية R مميزة لذى نقول أنه كايرالي Chiral أو مركز ناشط بصريا. ونتيجة لهذه الخاصية، فان كل حمض ألفا-أميني متواجد في الطبيعة على شكل نظيرتين بصريتين Stereoisomers، يمينية Dextrogyre ويرمز لها، في الكيمياء الحيوية، بـ D، أو يسارية Levogyre ويرمز لها بـ L. ومعنى ذلك فيزيائيا أنها تقوم بازاحة الضوء المستقطب بزاوية معينة اما باتجاه عقارب الساعة بنسبة للنضيرة D، وهو الاتجاه الموجب (+)، أو ضد اتجاه عقارب الساعة بنسبة للنضيرة L، وهو الاتجاه السالب (-). وبالنسبة لنظام التسمية R / S، الأكثر استعملا في الكيمياء العضوية، فان نفس المبدأ يتبع حسب قاعدة "كان إنجولد بريلوج" فــ D == R وL == S.ولا تنطبـق هـذه القـاعدة الا على السيستيـن (بالإنجليزية: Cysteine) لأن الجذر الكبريتي ليسـت له الأولوية في هذه الحالــة. اذن فالـ D -سيستين هو الـ S -سيستين، والـ L -سيستين هو الـ R -سيستين [2].
و في المثال الموجود على النموذج المقابل، نجد الـ D -ألانين وكأنه صورة عبر المرآة لالـ L -ألانين، وهما مركبان لا يمكن مطابقتهما non-superimposable، تماما كما لا يمكن مطابقة قفى اليد اليمنى مع ظهر اليد اليسرى صورة. ولسبب لا يزال محيرا، فان غالبية الأحماض الألفا-أمينية المكونة للبروتينات هي من النضيرة L وليست D. ولكن يمكن أن نجد بعض الـ D-أحماض أمينية في أنواع مـن الصدفيات [3] مثل عائلة الكونيدات Conidae، وفي الغشاء البيبتدوسكري Peptidoglycan لبعض البكتيريا [4].
الثلاثاء، 10 يناير 2012
الاحماض / قراءة اثرائية
اولاً: الاحماض.
أ- خصائص الاحماض.
- معظمها قابل للذوبان في الماء.
-تغير لون تباع الشمس الى اللون الاحمر.
- لها طعم لاذع.
الحمض :هو الكتروليت يعطي كاتيون H+ عند ذوبانه في الماء
ب- تصنيف الاحماض.
أ- طبيعة الحمــــض: 1- احماض عضويه -2- احماض غير عضويه.
ب- عدد البروتونات: 1- احاديه البروتون -2-ثنائيه البروتون -3- متعددة البروتون.
ج- استخدامات الاحماض في حياتنا.
1- المسكنات الحمضيه (الاسبرين والبروفين)
2-الكبريتيك (بطارية السيارة)
3-النيتريك (صناعة المتفجرات)
علل: يستخدم الليمون في المنازل لتلميع الاواني النحاسيه؟
ج: الان الليمون يعمل على إذابة طبقه الاكسيد بفعل التأكل فيصبح سطح النحاس لامعاً.
ثانياً: القواعد.
أ- خصائص القواعد.
- محاليلها المائيه ذات ملمس صابوني.
-تغير لون تباع الشمس الى اللون الازرق.
- لها طعم مر.
ب- تصنيف القواعد.
أ- عدد مجموعات الهيدروكسيد: 1-احاديه الهيدروكسيد -2ثنائيه الهيدروكسيد -3- متعددة الهيدروكسيد.
ب- قوه القاعده.
ج- استخدامات القواعد.
1- هيدروكسيد الصوديوم (صناعه الرايون والسيراميك)
2- هيدروكسيد الكالسيوم (معالجه التربه الحمضيه)
3-كربونات الصوديوم (معالجه الاصابات الناتجه عن الاحماض في المختبر)
علل: يستخدم الهيدروكسيد الصوديوم في تنظيف افران الطبخ من الدهون والشحوم؟
ج: الانه يعمل على اذابة الدهون والشحوم.
الاس الهيدروجيني
الاس الهيدروجيني: هو اسلوب للتعبير عن درجه الحموضه للمحاليل المائيه .
س: ما اسم جهاز قياس الاس الهيدروجيني لمحلول ؟ ج : مقياس الحموضه (PHmeter )
الكاشف العام : هو عباره عن خليط من كواشف مختلفه .
الكواشف: مواد عضويه تعطي لونا خاصاً مع محاليل الاحماض ولوناً اخر مع محاليل القواعد.
المطر الحمضي
المطر الحمضي : هو المطر الذي درجه حموضته أقل من (5) .
اثار المطر الحمضي.
1- يجعل مياه البحيرات والانهار حامضيه.
2-تسبب تحرر كتيونات فلزات من الصخور لتصل الى مصادر مياه الشرب وتسبب لها درجه من السميه.
3-تسبب تدمير الاشجار .
الطاقه والوقود
الطاقه : هي القدره على اداء شغل او انتاج حراره.
الوقود: الماده التي يمكن ان تستخدم مصدراً للطاقه يمكن الاعتماد عليه.
الوقود الاحفوري: احد المصارد الرئيسيه الانتاج الطاقه اللازمه لتوليد الكهرباء وتشغيل الالات ووسائل النقل.
الوقود الاحفوري
الطاقه غيرالمتجددة: المصادرالتي تكونت في الارض منذ ملايين السنين ولا يمكن تجديدها في فتره زمنيه قصيره.
يتكون الوقود الاحفور من ثلاثه انواع :-
1- الفحم.
2- النفط الخام.
3- الغاز الطبيعي.
تابع الوقود الاحفوري
مميزات الوقود الاحفوري:
1- يحترق بسهوله منتجاً كميه كبيره من الطاقه الحراريه.
2- سهل النقل
سلبيات الوقود الاحفوري:
1- ارتفاع درجه حراره الارض.
2- تكوين المطر الحمضي.
وقود المستقبل
اولاً : الوقود النووي.
اليورانيوم المخصب: اليورانيوم بعد ربع نسبه النظير 235
التفاعل الانشطاري: عباره عن انشطار نواه ذره عنصر ثقيل كاليورانيوم الى نواتي عنصرين اقل في الكتله الذريه واكثر استقراراً حيث تتحرر الطاقه في هذا المفاعل .
مميزات الوقود النووي:
1- الحصول على كميه هائله من الطاقه الحراريه.
2- لا ينتج عن هذا المفاعل اية ملوثات غازيه للهواء.
سلبيات الوقود النووي:
1- ارتفاع التكاليف الماديه الانشاء وصيانه المفاعلات الذرية.
2- صعوبه تخزين ومعالجه نفايات المواد المشعه .
3-حدوث التسرب الاشعاعي يؤدي الى تأثيرات صحيه خطيره.
ثانياً : وقود الهيدروجين.
خواص غاز الهيدروجين:
1- عديم اللون والرائحه والطعم.
2- غير سام.
3- سريع الاشتعال.
تابع وقود الهيدروجين
مميزات وقود الهيدروجين:
1- عندما يحترق في وجود الاكسجين النقي لا ينتج غير الماء والحراره.
2- مقدار الطاقه الناتجه عن احتراقه مرتفعه مقارنه بالوقود الاحفوري.
3- يتم انتاجه من مصادر متجدده ومتوفره مثل الماء.
سلبيات وقود الهيدروجين:
1- ارتفاع تكلفه انتاجه.
2- ارتفاع تكلفه تخزينه ونقله.
3-انبعاث بعض اكاسيد النيتروجين عند احتراقه في ظروف معينه.
س: لماذا لايوجدغاز الهيدروجين في الغلاف الجوي؟ ج: لقله كثافته مما ادى الى تسربه خارج الغلاف الجوي.
ثالثاً : الوقود الحيوي.
الكتله الحيويه : المواد العضويه سواء كانت طبيعيه أو معالجه. مثل بقايا الاشجار – البقايا الحيوانيه.
طرق معالجه المواد العضويه:
1) التخمر: تخمير الفضلات النباتيه والحيوانيه بواسطه انواع من البكتيريا وفي غياب الاكسجين.
2) الانحلال الحراري: تسخين المواد العضويه الى درجات حرارة عاليه في غياب الاكسجين.
مميزات الوقود الحيوي:
1- تمتاز الانواع المختلفه منه بانها صديقه للبيئه.
2- توفر الكتله الحيويه وهي مصدر هذا الوقود في جميع انحاء العالم .
3- معظم انواع هذا الوقود ينتج عن احتراقه حراره تستغل لتوليد الطاقه الكهربائيه.
سلبيات الوقود الحيوي:
1- التكلفه المرتفعه لعمليات المعالجه.
2- اعتماد بعض الانواع من الوقود الحيوي على محاصيل الزراعيه .
مواصفات الوقود الجيد :
1- رخيص الثمن.
2-غير ملوث للبيئه.
3-سهل الاشتعال والحرق.
أ- خصائص الاحماض.
- معظمها قابل للذوبان في الماء.
-تغير لون تباع الشمس الى اللون الاحمر.
- لها طعم لاذع.
الحمض :هو الكتروليت يعطي كاتيون H+ عند ذوبانه في الماء
ب- تصنيف الاحماض.
أ- طبيعة الحمــــض: 1- احماض عضويه -2- احماض غير عضويه.
ب- عدد البروتونات: 1- احاديه البروتون -2-ثنائيه البروتون -3- متعددة البروتون.
ج- استخدامات الاحماض في حياتنا.
1- المسكنات الحمضيه (الاسبرين والبروفين)
2-الكبريتيك (بطارية السيارة)
3-النيتريك (صناعة المتفجرات)
علل: يستخدم الليمون في المنازل لتلميع الاواني النحاسيه؟
ج: الان الليمون يعمل على إذابة طبقه الاكسيد بفعل التأكل فيصبح سطح النحاس لامعاً.
ثانياً: القواعد.
أ- خصائص القواعد.
- محاليلها المائيه ذات ملمس صابوني.
-تغير لون تباع الشمس الى اللون الازرق.
- لها طعم مر.
ب- تصنيف القواعد.
أ- عدد مجموعات الهيدروكسيد: 1-احاديه الهيدروكسيد -2ثنائيه الهيدروكسيد -3- متعددة الهيدروكسيد.
ب- قوه القاعده.
ج- استخدامات القواعد.
1- هيدروكسيد الصوديوم (صناعه الرايون والسيراميك)
2- هيدروكسيد الكالسيوم (معالجه التربه الحمضيه)
3-كربونات الصوديوم (معالجه الاصابات الناتجه عن الاحماض في المختبر)
علل: يستخدم الهيدروكسيد الصوديوم في تنظيف افران الطبخ من الدهون والشحوم؟
ج: الانه يعمل على اذابة الدهون والشحوم.
تذكر:
PH يساوي 7 (متعادل)
PH اقــــل7 (حمضي)
PH اكـــبر7 (قلــــوي)
PH يساوي 7 (متعادل)
PH اقــــل7 (حمضي)
PH اكـــبر7 (قلــــوي)
الاس الهيدروجيني
الاس الهيدروجيني: هو اسلوب للتعبير عن درجه الحموضه للمحاليل المائيه .
س: ما اسم جهاز قياس الاس الهيدروجيني لمحلول ؟ ج : مقياس الحموضه (PHmeter )
الكاشف العام : هو عباره عن خليط من كواشف مختلفه .
الكواشف: مواد عضويه تعطي لونا خاصاً مع محاليل الاحماض ولوناً اخر مع محاليل القواعد.
المطر الحمضي
المطر الحمضي : هو المطر الذي درجه حموضته أقل من (5) .
اثار المطر الحمضي.
1- يجعل مياه البحيرات والانهار حامضيه.
2-تسبب تحرر كتيونات فلزات من الصخور لتصل الى مصادر مياه الشرب وتسبب لها درجه من السميه.
3-تسبب تدمير الاشجار .
الطاقه والوقود
الطاقه : هي القدره على اداء شغل او انتاج حراره.
الوقود: الماده التي يمكن ان تستخدم مصدراً للطاقه يمكن الاعتماد عليه.
الوقود الاحفوري: احد المصارد الرئيسيه الانتاج الطاقه اللازمه لتوليد الكهرباء وتشغيل الالات ووسائل النقل.
الوقود الاحفوري
الطاقه غيرالمتجددة: المصادرالتي تكونت في الارض منذ ملايين السنين ولا يمكن تجديدها في فتره زمنيه قصيره.
يتكون الوقود الاحفور من ثلاثه انواع :-
1- الفحم.
2- النفط الخام.
3- الغاز الطبيعي.
تابع الوقود الاحفوري
مميزات الوقود الاحفوري:
1- يحترق بسهوله منتجاً كميه كبيره من الطاقه الحراريه.
2- سهل النقل
سلبيات الوقود الاحفوري:
1- ارتفاع درجه حراره الارض.
2- تكوين المطر الحمضي.
وقود المستقبل
اولاً : الوقود النووي.
اليورانيوم المخصب: اليورانيوم بعد ربع نسبه النظير 235
التفاعل الانشطاري: عباره عن انشطار نواه ذره عنصر ثقيل كاليورانيوم الى نواتي عنصرين اقل في الكتله الذريه واكثر استقراراً حيث تتحرر الطاقه في هذا المفاعل .
مميزات الوقود النووي:
1- الحصول على كميه هائله من الطاقه الحراريه.
2- لا ينتج عن هذا المفاعل اية ملوثات غازيه للهواء.
سلبيات الوقود النووي:
1- ارتفاع التكاليف الماديه الانشاء وصيانه المفاعلات الذرية.
2- صعوبه تخزين ومعالجه نفايات المواد المشعه .
3-حدوث التسرب الاشعاعي يؤدي الى تأثيرات صحيه خطيره.
ثانياً : وقود الهيدروجين.
خواص غاز الهيدروجين:
1- عديم اللون والرائحه والطعم.
2- غير سام.
3- سريع الاشتعال.
تابع وقود الهيدروجين
مميزات وقود الهيدروجين:
1- عندما يحترق في وجود الاكسجين النقي لا ينتج غير الماء والحراره.
2- مقدار الطاقه الناتجه عن احتراقه مرتفعه مقارنه بالوقود الاحفوري.
3- يتم انتاجه من مصادر متجدده ومتوفره مثل الماء.
سلبيات وقود الهيدروجين:
1- ارتفاع تكلفه انتاجه.
2- ارتفاع تكلفه تخزينه ونقله.
3-انبعاث بعض اكاسيد النيتروجين عند احتراقه في ظروف معينه.
س: لماذا لايوجدغاز الهيدروجين في الغلاف الجوي؟ ج: لقله كثافته مما ادى الى تسربه خارج الغلاف الجوي.
ثالثاً : الوقود الحيوي.
الكتله الحيويه : المواد العضويه سواء كانت طبيعيه أو معالجه. مثل بقايا الاشجار – البقايا الحيوانيه.
طرق معالجه المواد العضويه:
1) التخمر: تخمير الفضلات النباتيه والحيوانيه بواسطه انواع من البكتيريا وفي غياب الاكسجين.
2) الانحلال الحراري: تسخين المواد العضويه الى درجات حرارة عاليه في غياب الاكسجين.
مميزات الوقود الحيوي:
1- تمتاز الانواع المختلفه منه بانها صديقه للبيئه.
2- توفر الكتله الحيويه وهي مصدر هذا الوقود في جميع انحاء العالم .
3- معظم انواع هذا الوقود ينتج عن احتراقه حراره تستغل لتوليد الطاقه الكهربائيه.
سلبيات الوقود الحيوي:
1- التكلفه المرتفعه لعمليات المعالجه.
2- اعتماد بعض الانواع من الوقود الحيوي على محاصيل الزراعيه .
مواصفات الوقود الجيد :
1- رخيص الثمن.
2-غير ملوث للبيئه.
3-سهل الاشتعال والحرق.
الاستعمالات الحياتية للقواعد
الاستعمالات الحياتية للقواعد
صفتها ووجودها | الصيغة | اسم القاعدة |
قاعدة قوية ، تسمى الصودا الكاوية وتستخدم في صناعة الصابون . | NaOH | هيدروكسيد الصوديوم |
قاعدة قوية ، وتستخدم في صناعة المنظفات . | KOH | هيدروكسيد البوتاسيوم |
قاعدة ضعيفة ، توجد في محاليل تنظيف الزجاج . | NH3 | أمونيا |
قاعدة قوية ، وتدعى الجير المطفأ . | Ca(OH)2 | هيدروكسيد الكالسيوم |
قاعدة ضعيفة ، تستخدم في أدوية مضادات الحموضة . | Mg(OH)2 | هيدروكسيد المغنيسيوم |
الاحماض في حياتنا /ابداعات كيميائية
الأحماض في حياتنا
05 نوفمبر, 2011 | By إبداعات كيميائية
استخدامات الاحماض في حياتنا.
1- تستخدم في صناعة المسكنات الحمضيه (الاسبرين والبروفين)
2- يستخدم حمض الكبريتيك في صناعة بطارية السيارة
3-يستخدم حمض النيتريك في صناعة المتفجرات
- تحضير الأحماض:
في الصناعة:
أ ـ تحضر الأحماض ثنائية العنصر غالباً بالاتحاد المباشر بين الهيدروجين والعنصر اللافلزي ثم إذابة المركب الناتج (غاز) في الماء.
ب ـ تحضر الأحماض ثلاثية العنصر (الأكسجينية) بالاتحاد المباشر بين الأكسجين والعنصر اللافلزي للحصول على أنهيدريد الحمض ثم إذابته في الماء.
في المختبر:
يمكن تحضير الحمض الأقل ثباتاً بتفاعل ملحه مع حمض أكثر ثباتاً.
أ _ التحليل المائي لهاليدات اللافلزات وبعض الفلزات.
ب _ أكسدة العناصر اللافلزية في محلول مائي خال من القلويات.
المواد الضارة فى حياتنا اليومية
1 - الصودا الكاوية:
إن الأحماض الكاوية تستخدم كمادة مزيلة للأحبار وكمادة ملمعة وللونها الأبيض يتم تعاطيها عن طريق الخطأ من قبل الأطفال علي أنها مادة سكرية، ويسبب هذا الحمض تقيحات وترسيب الكالسيوم حيث أن الكالسيوم ضروري جداًً لعملية التجلط وكذلك انتظام عمل الخلايا العصبية،كما ينتاب الشخص التشنجات لقلة الكالسيوم وحصوات في قناة مجري البول التى تؤدي إلي خلل في وظيفة الكلي وفشل كلوي. ومن هذه الأحماض أيضاً (ديتول - ليثول)، هما مطهران للجروح ويظنه الأطفال علي أنه عسل ويؤديان إلي خلل في الجهاز العصبي وفشل في التنفس والتهاب في الكلي وفشل في وظيفتها أيضاً. أما الأحماض العضوية مثل حمض الكبريتيك الذي يستخدم في نظافة الأرضيات والأحواض يؤدي إلي احتراق المريء وتليفه ومن ثم ضيق تام وانسداد فيه. والقلويات مثل البوتاس والذى يستخدم في تنظيف الملابس له نفس تأثير الأحماض غير العضوية.
2- الغازات والأبخرة:
تلك المستخدمة في المنازل مثل النشادر الذي يستخدم في الإفاقة، يؤدي استنشاقه بكثرة إلي تورم في الغشاء المخاطي والقصبة الهوائية والأنف.
3- السموم النباتية:
1- الأتروبين (Atropine): الذي يوجد في نبات الدالوزا، يؤدي إلي تنبيه الجهاز العصبي يتبعه حالة من تثبيط وظائف التنفس وهبوط الدورة الدموية.
2- ديجيتال (Digitalis): عقار يستخدم في علاج وظائف القلب. وتناول جرعات زائدة منه يؤدى إلىعدم انتظام ضربات القلب وبطء في النبض وهبوط حاد فى الضغط وممكن أن يحدث الوفاة.
3- الهيستامين (Histamine): عبارة عن عقار يستخلص من نبات شيليم، عند أخذه بطريقة خاطئة يؤدي إلي ضيق في الشرايين وارتفاع في ضغط الدم، حدوث جلطات في الأوعية الدموية والمخ مسببة تشنجات عصبية ومن ثم الوفاة.
4- سموم معدنية:
1- الرصاص: خلات الرصاص تستخدم في علاج الكدمات أو كمادة من مواد الدهانات تناولها عن طريق الخطأ ينجم عنه تشنجات وتقلصات شديدة بالمعدة.
2- الزرنيخ: ويتكون في الأواني النحاسية وفي بعض المبيدات الحشرية مثل سم الفئران، يؤدي إلي نوبات إسهال تشبه إسهال الكوليرا، والاستمرار عليه يسفر عن تساقط الشعر، وأمراض الحساسية، والتهاب كبدي، وهبوط في وظائف القلب.
3- الفوسفور: يؤدي إلي التهاب الكبد والصفراء، نقـص فــي عامل التجلط الثاني (Prothrombin) الذي يزيد من احتمالات التعرض للنزيف.
5- سموم متبخرة:
1- كحول إيثيلي:
وموجود في الخمور أو كمطهر ويؤدي إلي:
- هبوط في الدورة الدموية.
- عدم انتظام في التنفس.
- عدم انتظام النبض.
- أو الوفاة بسبب هبوط في الدورة الدموية.
2- كحول ميثيلي:
موجود في المنازل كوسيلة للإشعال وهي أشد خطورة من الكحول الأبيض، مسبباًً التهاب العصب البصري ومن ثم العمي تثبيط في الجهاز العصبي المركزي مؤدياً إلي الغيبوبة.
3- الكيروسين:
يستعمل كوسيلة إشعال في المنازل ----> تثبيط في الجهاز العصبي المركزي ---> غيبوبة، والتهاب رئوي حاد.
4- صبغة اليود:
لا تؤدي إلي أضرار جسيمة.
6- غازات سامة:
ومنها أول أكسيد الكربون يتعرض له الشخص بسبب احتراق غاز الأكسجين وهذا الغاز له شراهة عالية للهيموجلوبين ويؤدي إلي الاختناق.
7- المبيدات الحشرية:
وتشمل النفتالين وديكسان وبيجون ---> حدوث استسقاء علي الرئة وتقلص في عضلات القصبة الهوائية.
8- العقاقير:
- الأسبرين ---> تناول جرعة عالية أكثر من 40 قرص تؤدى إلي فشل كلوي حاد.
- المهدئات ---> هبوط حاد في الدورة الدموية، تثبيط في التنفس ثم الوفاة.
- المضادات الحيوية:
كلورا ميفينكول (Chloramphenic ol) ---> فشل في وظائف النخاع وليس له علاقة بالجرعة.
درس المحاليل المائية والأحماض والقواعد .
برز أهميّة دراسة كيمياء الأحماض والقواعد في كونها مواد ذات أهميّة كبرى في حياتنا اليومية ، فهي مواد ترتبط بشؤوننا الحياتية بشكلٍ كبير ، حيث أنّها تدخل في غذائنا وفي كثيرٍ من المواد التي نستخدمها ، كما أنّ لها مكانة واسعة وهامّة في الصناعة ، وأيضاً في دراساتنا الكيميائية العملية ، فالكثير من التفاعلات التي نجريها في المختبر يكون الحمض أو القاعدة أحد مكوّناتها ، سواءً كانت مادةً أساسية في التفاعل أم مجرّد وسط يتم فيه التفاعل الكيميائي .
وتعتبر المحاليل المائية للأحماض والقواعد من أهمّ المحاليل لكونها محاليل ذات أهميّة حيوية بالغة ، فالتفاعلات الحيوية الّتي تحدث داخل أجسامنا تتمّ في وسط مائي حمضي أو قاعدي ، وأيّ اختلاف ولو كان بسيطاً في تركيز هذه المحاليل قد يحدث تغييراً في هذه التفاعلات وقد ينتج عنه إختلالاً في وظائف الأعضاء .
إخواني وأخواتي أرحّب بكم مع درس جديد من دروسنا الكيميائية المشروحة ، هذا الدرس سيَقدّم بحول الله وقوّته على ثلاثة أجزاء وبطريقة جديدة ومختلفة عن الدروس السابقة .
الجديد هنا هو أنّ هذه الدروس الثلاثة معدّة لتَنفّذ بطريقة التعلّم التعاوني ، وسأحاول هنا شرح الآلية التي يمكن من خلالها تنفيذ دروس التعلّم التعاوني .
موضوع الدرس : المحاليل المائية والأحماض والقواعد .
أهداف الدرس
يتوقع من الطالب في نهاية الدرس أن :
1- يبيّن أهمية دراسة المحاليل المائية في علم الكيمياء .
2- يوضّح أهمية دراسة الأحماض والقواعد .
3- يعرّف كلاً من الالكتروليت ( المواد المواصلة ) واللاالكتروليت ( المواد غير المواصلة ) .
4- يمثّل للالكتروليت واللاالكتروليت مدعماً تمثيله بمعادلة كيميائية .
5- يميّز بين الالكتروليت القوي والالكتروليت الضعيف .
6- يمثّل للالكتروليت القوي والالكتروليت الضعيف مدعماً تمثيلها بمعادلة كيميائية .
7- يفرّق بين التفكك والتأين مع التمثيل .
8- يذكر خمساً من خواص الأحماض المميزة .
9- يذكر خمساً من خواص القواعد المميزة .
10- يكتب أسماء وصيغ خمساً من الأحماض وخمساً من القواعد .
11- يعرّف الحمض وفق النظرية الأيونية ( نظرية التفكك لأرهينيوس ) .
12- يعرّف القاعدة وفق النظرية الأيونية ( نظرية التفكك لأرهينيوس ) .
13- يميّز بين الحمض والقاعدة وفق نظرية لاوري وبرونشتد .
14- يعرّف الزوج المقترن .
15- يمثّل للزوج المقترن في معادلة كيميائية .
16- يذكر مفهوم لويس للأحماض والقواعد .
17- يشرح مفهوم لويس للأحماض والقواعد في معادلة كيميائية موزونة .
التعلّم التعاوني :
استراتيجية تعليمية يتعلّم فيها الطلاب من خلال العمل في مجموعات صغيرة غير متجانسة يتعاون أفرادها في إنجاز المهمات التعليمية المنوطة بهم .
مبرّرات استخدام استراتيجية التعلّم التعاوني في التدريس :
وجود أدلّة قوية على فاعلية التعلّم التعاوني في تحسين تعلّم الطلاب ، وتحقيق فوائد أخرى كثيرة لهم على صعيد التحصيل وتنمية التفكير والعلاقات الاجتماعية الإيجابية ، فقد أثبتت الدراسات الحديثة أنّ الطلاّب اللذين يدرسون بطريقة التعلّم التعاوني :
- يستخدمون عمليات التفكير الاستدلالي بشكل أكبر .
- يكون تحصيلهم أعلى .
- يأخذون وجهات نظر الآخرين بعين الاعتبار وتنشأ بينهم علاقات إيجابية .
- يتمتعون بدافعيه داخلية أعلى .
- يصبح لديهم اتجاهات أفضل نحو المدرسة ونحو المعلمين .
- يصبح لديهم تقدير أعلى للذات .
- قادرون على التكيف الإيجابي نفسياً واجتماعياً في حياتهم الخاصة .
- يميلون لتنفيذ مزيد من المهمات التعاونية .
آلية تنفيذ درس بالتعلّم التعاوني :
1- يتمّ تقسيم الطلاّب إلى مجموعات غير متجانسة ( متفاوتون في مستواهم الدراسي ) بحيث يكون في كلّ مجموعة 3-6 طلاّب ، ويوكل لكلّ طالب في كلّ مجموعة دور يقوم به ( رئيس ، مقرّر ، متحدّث ... الخ ) .
2- يبدأ المعلّم درسه بمقدّمه سريعة لمدة خمس دقائق مثلاً يعطي فيها فكرة عامة عن الدرس والأهداف الّتي يرغب في تحقيقها مع الطلاّب من خلال العمل التعاوني .
3- يطرح المعلّم ورقة العمل الأولى ، بعد التمهيد للنشاط لضمان فهم الطلاّب لمحتوى ورقة العمل ويوضح لهم المطلوب منهم القيام به .
4-التأكيد على ضرورة توفّر خلفية تعليمية لدى الطلاّب ينطلقون منها لممارسة النشاط التعليمي المطروح في ورقة العمل ، قد تكون هذه الخلفية عبارة عن الخبرات السابقة للطلاّب ، الدرس السابق ، المقدّمة التّي بدأ بها المعلّم الدرس ، أو حتى قراءتهم للدرس في الكتاب لمدّة زمنية معيّنة يحدّدها المعلّم قبل البدء في النشاط .
5- يعطي المعلّم فرصة ليتناقش أفراد كلّ مجموعة مع بعضهم البعض والخروج في نهاية الزمن المخصّص برأي موّحد ونتاج واحد .
6- تعرض كلّ مجموعة نتاج عملها أمام الطلاّب ويدور نقاش حول ما يعرض ، ثم يكتب المعلّم ملخص بسيط على السبورة عن أهمّ ما توصّل إليه .
7- تنّفذ بقية النشاطات ( أوراق العمل ) بنفس الألية حسب ما يسمح به وقت الحصّة .
8- في نهاية الدرس يقوم المعلّم بعملية تقويم للتأكد من تحقّق أهداف الدرس لدى الطلاّب ، ويتيح لهم الفرصة لكتابة الملخص السبوري .
وتعتبر المحاليل المائية للأحماض والقواعد من أهمّ المحاليل لكونها محاليل ذات أهميّة حيوية بالغة ، فالتفاعلات الحيوية الّتي تحدث داخل أجسامنا تتمّ في وسط مائي حمضي أو قاعدي ، وأيّ اختلاف ولو كان بسيطاً في تركيز هذه المحاليل قد يحدث تغييراً في هذه التفاعلات وقد ينتج عنه إختلالاً في وظائف الأعضاء .
إخواني وأخواتي أرحّب بكم مع درس جديد من دروسنا الكيميائية المشروحة ، هذا الدرس سيَقدّم بحول الله وقوّته على ثلاثة أجزاء وبطريقة جديدة ومختلفة عن الدروس السابقة .
الجديد هنا هو أنّ هذه الدروس الثلاثة معدّة لتَنفّذ بطريقة التعلّم التعاوني ، وسأحاول هنا شرح الآلية التي يمكن من خلالها تنفيذ دروس التعلّم التعاوني .
موضوع الدرس : المحاليل المائية والأحماض والقواعد .
أهداف الدرس
يتوقع من الطالب في نهاية الدرس أن :
1- يبيّن أهمية دراسة المحاليل المائية في علم الكيمياء .
2- يوضّح أهمية دراسة الأحماض والقواعد .
3- يعرّف كلاً من الالكتروليت ( المواد المواصلة ) واللاالكتروليت ( المواد غير المواصلة ) .
4- يمثّل للالكتروليت واللاالكتروليت مدعماً تمثيله بمعادلة كيميائية .
5- يميّز بين الالكتروليت القوي والالكتروليت الضعيف .
6- يمثّل للالكتروليت القوي والالكتروليت الضعيف مدعماً تمثيلها بمعادلة كيميائية .
7- يفرّق بين التفكك والتأين مع التمثيل .
8- يذكر خمساً من خواص الأحماض المميزة .
9- يذكر خمساً من خواص القواعد المميزة .
10- يكتب أسماء وصيغ خمساً من الأحماض وخمساً من القواعد .
11- يعرّف الحمض وفق النظرية الأيونية ( نظرية التفكك لأرهينيوس ) .
12- يعرّف القاعدة وفق النظرية الأيونية ( نظرية التفكك لأرهينيوس ) .
13- يميّز بين الحمض والقاعدة وفق نظرية لاوري وبرونشتد .
14- يعرّف الزوج المقترن .
15- يمثّل للزوج المقترن في معادلة كيميائية .
16- يذكر مفهوم لويس للأحماض والقواعد .
17- يشرح مفهوم لويس للأحماض والقواعد في معادلة كيميائية موزونة .
التعلّم التعاوني :
استراتيجية تعليمية يتعلّم فيها الطلاب من خلال العمل في مجموعات صغيرة غير متجانسة يتعاون أفرادها في إنجاز المهمات التعليمية المنوطة بهم .
مبرّرات استخدام استراتيجية التعلّم التعاوني في التدريس :
وجود أدلّة قوية على فاعلية التعلّم التعاوني في تحسين تعلّم الطلاب ، وتحقيق فوائد أخرى كثيرة لهم على صعيد التحصيل وتنمية التفكير والعلاقات الاجتماعية الإيجابية ، فقد أثبتت الدراسات الحديثة أنّ الطلاّب اللذين يدرسون بطريقة التعلّم التعاوني :
- يستخدمون عمليات التفكير الاستدلالي بشكل أكبر .
- يكون تحصيلهم أعلى .
- يأخذون وجهات نظر الآخرين بعين الاعتبار وتنشأ بينهم علاقات إيجابية .
- يتمتعون بدافعيه داخلية أعلى .
- يصبح لديهم اتجاهات أفضل نحو المدرسة ونحو المعلمين .
- يصبح لديهم تقدير أعلى للذات .
- قادرون على التكيف الإيجابي نفسياً واجتماعياً في حياتهم الخاصة .
- يميلون لتنفيذ مزيد من المهمات التعاونية .
آلية تنفيذ درس بالتعلّم التعاوني :
1- يتمّ تقسيم الطلاّب إلى مجموعات غير متجانسة ( متفاوتون في مستواهم الدراسي ) بحيث يكون في كلّ مجموعة 3-6 طلاّب ، ويوكل لكلّ طالب في كلّ مجموعة دور يقوم به ( رئيس ، مقرّر ، متحدّث ... الخ ) .
2- يبدأ المعلّم درسه بمقدّمه سريعة لمدة خمس دقائق مثلاً يعطي فيها فكرة عامة عن الدرس والأهداف الّتي يرغب في تحقيقها مع الطلاّب من خلال العمل التعاوني .
3- يطرح المعلّم ورقة العمل الأولى ، بعد التمهيد للنشاط لضمان فهم الطلاّب لمحتوى ورقة العمل ويوضح لهم المطلوب منهم القيام به .
4-التأكيد على ضرورة توفّر خلفية تعليمية لدى الطلاّب ينطلقون منها لممارسة النشاط التعليمي المطروح في ورقة العمل ، قد تكون هذه الخلفية عبارة عن الخبرات السابقة للطلاّب ، الدرس السابق ، المقدّمة التّي بدأ بها المعلّم الدرس ، أو حتى قراءتهم للدرس في الكتاب لمدّة زمنية معيّنة يحدّدها المعلّم قبل البدء في النشاط .
5- يعطي المعلّم فرصة ليتناقش أفراد كلّ مجموعة مع بعضهم البعض والخروج في نهاية الزمن المخصّص برأي موّحد ونتاج واحد .
6- تعرض كلّ مجموعة نتاج عملها أمام الطلاّب ويدور نقاش حول ما يعرض ، ثم يكتب المعلّم ملخص بسيط على السبورة عن أهمّ ما توصّل إليه .
7- تنّفذ بقية النشاطات ( أوراق العمل ) بنفس الألية حسب ما يسمح به وقت الحصّة .
8- في نهاية الدرس يقوم المعلّم بعملية تقويم للتأكد من تحقّق أهداف الدرس لدى الطلاّب ، ويتيح لهم الفرصة لكتابة الملخص السبوري .
الاشتراك في:
الرسائل (Atom)


 هو المجموعة الجانبية التي تحدد طبيعة كل حمض الأميني.
هو المجموعة الجانبية التي تحدد طبيعة كل حمض الأميني.